Par Anouk ADALSBERG (assistante de chirurgie) et Hervé BRISSOT
DipECVS, spécialiste en chirurgie.
Un jeune Berger Allemand femelle entière d’un an et demi est présentée en urgence chez son vétérinaire traitant pour abattement sévère et distension abdominale évoluant depuis la veille. Face à l’assourdissement des bruits cardiaques, une échocardiographie est réalisée révélant la présence d’un épanchement péricardique marqué avec tamponnade cardiaque associée. La biochimie et hématologie sanguines sont dans les intervalles de référence. Une péricardiocentèse décompressive échoguidée sous sédation (Butorphanol 0,2 mg/kg IV ; perfusion NaCl 0,9 % 2 mL/kg/h, Lidocaïne locale) est rapidement réalisée, et l’animal est référé au centre vétérinaire AzurVet le lendemain pour la suite de la prise en charge.
A l’admission, l’examen clinique révèle une auscultation cardiaque assourdie à droite, des veines jugulaires distendues, des pouls fémoraux faibles bilatéralement et un abdomen distendu. Des radiographies thoraciques vigiles sont réalisées et mettent en évidence (Figure 1 et 2) une augmentation de taille de la silhouette cardiaque avec une déformation inhabituelle du bord droit (sans continuité avec le bord G - flèches) et une dilatation de la veine cave caudale. Un discret épanchement pleural est visible en amont du cœur avec présence d’une scissure interlobaire sur la vue dorso-ventrale. Compte tenu de la déformation focale du contour cardiaque, le diagnostic différentiel inclut une hernie atriale droite, une hernie péritonéo-péricardique cloisonnée, un kyste, abcès, hématome ou tumeur péricardique.

Fig. 2 et Fig. 1
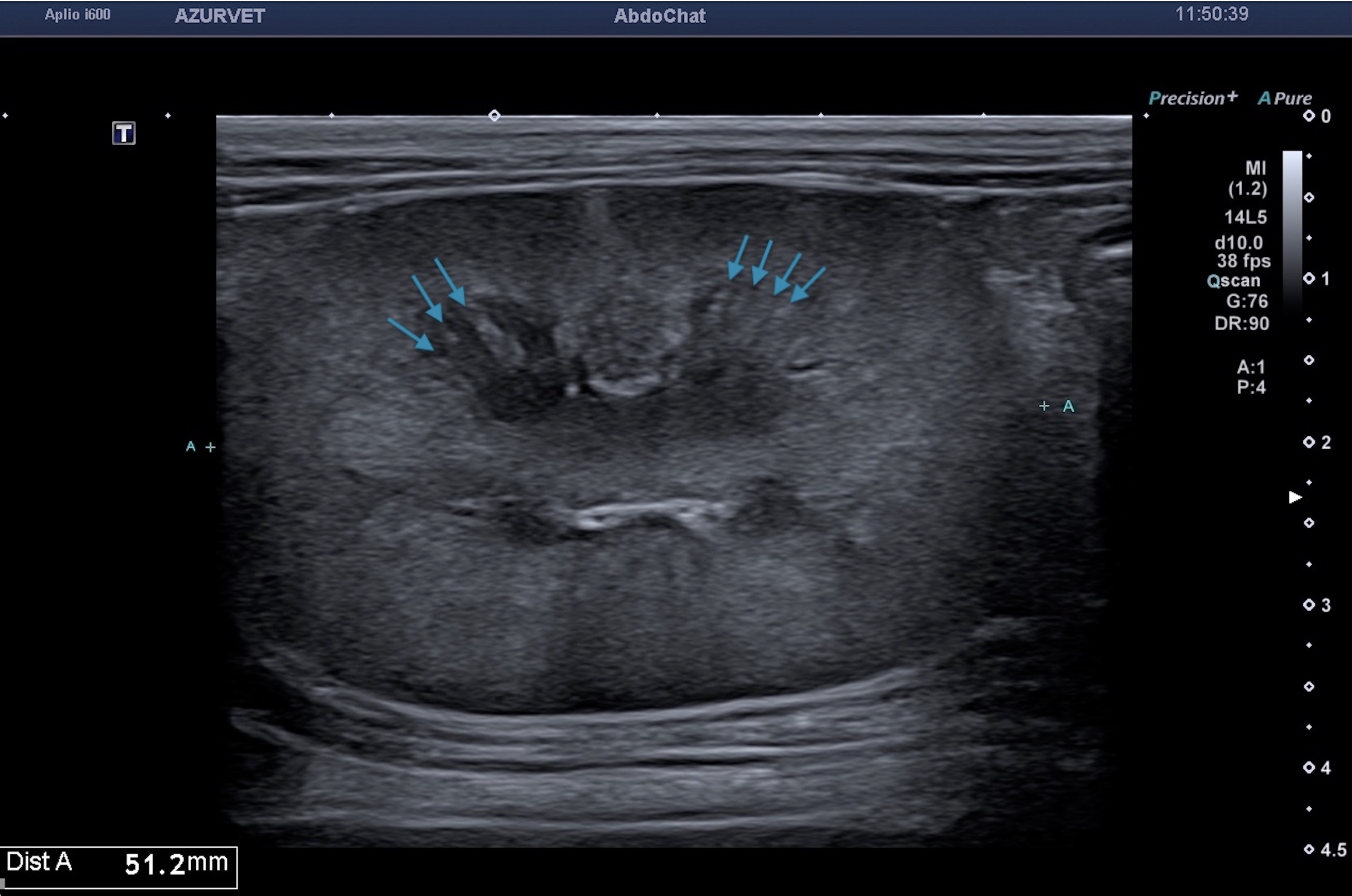
Une échocardiographie est ensuite réalisée et met en évidence une cavité liquidienne péricardique droite d’aspect anéchogène avec présence en son sein de multiples travées (Figure 3). L’atrium droit et le ventricule droit sont presque complètement collabés en phase diastolique. Les cavités gauches sont également très fortement diminuées de taille. Ce collapsus atrial et ventriculaire droit et gauche suggère de nouveau la présence d’une tamponnade cardiaque. Aucune autre lésion cardiaque n’est visible. Etant donné l’aspect focal de l’épanchement, l’âge de l’animal, et les images échocardiographiques, un diagnostic de kyste péricardique associé à une tamponnade sévère est alors établi, même si une hernie péritonéo-péricardique associée ne peut être exclue à ce stade.

Fig. 3
Traitement
Une péricardiocentèse par ponction du kyste sous sédation est à nouveau réalisée et permet de lever la tamponnade cardiaque et stabiliser l’animal. Compte tenu de la recollection rapide de la cavité péricardique, en accord avec les propriétaires, une prise en charge chirurgicale est réalisée à la suite de la péricardiocentèse.
L’approche chirurgicale choisie sur ce cas est la péricardectomie sous phrénique par thoracoscopie. Un cathéter intraveineux est placé dans la veine céphalique droite, l’animal est prémédiqué avec de la Méthadone (0,2 mg/kg IV) et Midazolam (0,2 mg/kg IV). L’anesthésie générale est induite par injection de Propofol (2 mg/kg IV lente). Après intubation endotrachéale, l’anesthésie est maintenue sous isoflurane dans 100 % d’oxygène. Une ventilation à pression positive intermittente est mise en place juste avant ouverture de la cavité thoracique. Une antibioprophylaxie est mise en place 30 minutes avant le début de la chirurgie (Céphazoline 20 mg/kg IV). Un monitorage régulier des paramètres vitaux (fréquence cardiaque, fréquence respiratoire, saturation artérielle en oxygène, pression artérielle) est réalisé tout au long de la procédure, et une bonne analgésie est maintenue par l’intermédiaire d’une infusion constante de Fentanyl/Kétamine (0,1 mg/kg). Le chien est positionné en décubitus dorsal, quatre points d’entrée sont réalisés. Un port subxiphoïdien est placé en premier, permettant d’y passer un scope rigide afin de guider le placement des autres ports. Deux autres ports sont alors placés en intercostal droit et un port en intercostal gauche, permettant une bonne visualisation du péricarde et du kyste. Une péricardectomie subtotale avec retrait du kyste et d’un maximum d’adhérences sont ensuite réalisés. Une fibrose importante du péricarde est visible et la partie viscérale du kyste apparait très adhérente au myocarde (Figure 4).

A : en haut à gauche - B : en haut à droite - C : milieu gauche - D : milieu droit - E : en bas à gauche
Aucune hernie péritonéo-péricardique n’est mise en évidence. Le péricarde et le kyste sont envoyés en analyse histologique et un drain thoracique posé avant la fin de l’intervention. Les ports thoraciques sont fermés de manière routinière, le drain thoracique fixé et mis sous vide. Le chien est réveillé et laissé sous Méthadone 0,2 mg/kg IV toutes les 4 heures pendant les 24 premières heures post opératoires et une fluidothérapie à débit d’entretien est maintenue (Ringer Lactate 2 ml/kg/h). L’antibiotique n’est pas continué en post opératoire, et le drain thoracique vidé toutes les 4 à 6 heures en fonction de la production. Le post opératoire se déroule sans encombre, une sortie d’hospitalisation est possible 4 jours plus tard après retrait du drain thoracique. Les soins au domicile comprennent un repos strict pendant 3 semaines et du paracétamol (10 mg/kg PO BID) 3 à 4 jours pour gestion de la douleur.
Le contrôle échocardiographique 3 mois post opératoire ne révèle plus aucune anomalie (Figure 5).

L’analyse histologique a mis en évidence un tissu mésenchymateux oedémateux, richement vascularisé, avec des cellules fibroblastiques d’aspect activé, un discret infiltrat neutrophilique et de grandes quantités de fibrine au sein du stroma et en superficie, compatible avec le diagnostic initial de kyste péricardique. Un an plus tard, les propriétaires rapportent un très bon état général, un chien de nouveau hyperactif et une échocardiographie normale chez le vétérinaire traitant.
Discussion
Les kystes péricardiques sont diagnostiqués aussi bien chez les chiens que chez les chats. L’étiopathogénie de ces kystes reste actuellement floue avec, à l’histologie, l’absence de couche de cellules endothéliales ou mésothéliales typique du kyste, mais présence en quantité significative de tissu graisseux, fibrine et fibres de collagène entourant la cavité. Dans la plupart des cas de kyste péricardique, une hernie diaphragmatique péritonéo-péricardique est associée, engendrant in fine une détresse respiratoire, obstruction intestinale et tamponnade cardiaque suite à la compression du cœur droit par le kyste (1,2,5,8).
Les cas de kystes péricardiques sont très peu documentés car rares, avec moins de quinze cas décrits sur les vingt dernières années en médecine vétérinaire et une personne sur cent mille atteinte en médecine humaine (0,001 %). Les animaux sont jeunes entre 6 mois et 3 ans sans prédisposition de sexe avec une apparition fréquemment aiguë des signes d’insuffisance cardiaque droite. Cette affection en médecine humaine concerne les femmes entre 40 et 50 ans et restent souvent asymptomatiques (4). Contrairement aux épanchements péricardiques classiques, la radiographie met en évidence une déformation localisée droite visible sur la vue dorso-ventrale du thorax. La radiographie thoracique est donc utile dans le diagnostic d’épanchement péricardique, est peu invasive pour l’animal, largement disponible et peu onéreuse. En revanche cela reste une technique peu sensible (31- 48 %) et moins spécifique (61-67%) que l’échocardiographie et le scanner. L’échographie reste l’examen de choix de première intention pour effectuer le diagnostic de tamponnade et de cavité cloisonnée versus masse, avec une sensibilité opérateur-dépendant mais pouvant aller jusqu’à 82 %. Cette technique ne nécessite pas d’anesthésie et peut alors être réalisée sur des animaux instables. En revanche, l’échocardiographie a des limites concernant l’identification des petites lésions, et ne met pas bien en évidence la relation anatomique du kyste avec les structures avoisinantes, ce qui peut être important pour la prise en charge chirurgicale. Le scanner aide à la planification chirurgicale, est davantage utile lors de hernie péritonéo-péricardique, et pour la détection des métastases pulmonaires non visibles à la radiographie lors de forte suspicion de processus tumoral (2,7,10). Néanmoins, l’accès restreint et le prix moins abordable du scanner limite son utilisation. Dans notre cas, le scanner ne fut pas réalisé en raison de l’instabilité clinique de l’animal.
Chez les chiens et chats, la péricardectomie est recommandée pour éviter les récidives. Ces récidives sont décrites comme élevées dans les jours à années suivant la péricardiocentèse. De plus, des ponctions répétées peuvent engendrer une péricardite constrictive (1,2). L’excision du kyste par péricardectomie est de bon pronostic à long terme (9). La thoracotomie intercostale ou par sternotomie est l’approche standard qui a pour avantages d’avoir une bonne exposition du péricarde et des autres structures épicardiques, et permet de prélever un échantillon de péricarde plus important et limite de ce fait le risque de faux négatifs à l’histopathologie. En revanche, cette technique est considérée comme l’une des procédures chirurgicales les plus douloureuses suite à la transsection des muscles et nerfs thoraciques, ce qui entraine in fine une récupération retardée et une durée d’hospitalisation plus longue. La thoracoscopie a plusieurs avantages par rapport à la thoracotomie, en étant moins invasive et ne nécessitant pas de rétraction des côtes, elle diminue la douleur post opératoire de façon significative, moins de complications de plaie et un retour plus rapide à la fonction (3,5,6,11). En revanche, plusieurs complications y compris un traumatisme du nerf phrénique, une lacération pulmonaire iatrogène, un saignement peropératoire et la nécessité d'une conversion en thoracotomie, ont été associées à la chirurgie thoracoscopique chez les petits animaux. De plus, cela nécessite une instrumentalisation avancée et une formation spécifique (2,3,5). Dans notre cas, aucune complication per opératoire ne fut détectée.
Le kyste péricardique congénital est une affection très rare chez le chien et le chat, qui engendre des signes d’insuffisance cardiaque congestive droite. La stabilisation de l’animal par péricardiocentèse est indispensable et doit être suivie du retrait chirurgical du kyste par péricardectomie subtotale. La thoracoscopie semble être une bonne alternative à la thoracotomie en diminuant significativement la douleur post opératoire et la durée d’hospitalisation. Après traitement chirurgical, le pronostic est bon à long terme.
References
1. Alkharabsheh, S., Gentry III, J. L., Khayata, M., Gupta, N., Schoenhagen, P., Flamm, S., Murthy, S., & Klein, A. L. (2019). Clinical Features, Natural History, and Management of Pericardial Cysts. The American Journal of Cardiology, 123(1), 159‑163. https://doi.org/10.1016/j.amjcard.2018.09.009
2. Bode, E. (2019). Pericardial disease in the dog and cat. Companion Animal, 24(5), 262‑270. https://doi.org/10.12968/coan.2019.24.5.262
3. Carvajal, J. L., Case, J. B., Mayhew, P. D., Runge, J., Singh, A., Townsend, S., & Monnet, E. (2018). Outcome in dogs with presumptive idiopathic pericardial effusion after thoracoscopic pericardectomy and pericardioscopy. Veterinary Surgery, 48(S1), O105‑O111. https://doi.org/10.1111/vsu.13129
4. Case, J. B., Maxwell, M., Aman, A., & Monnet, E. L. (2013). Outcome evaluation of a thoracoscopic pericardial window procedure or subtotal pericardectomy via thoracotomy for the treatment of pericardial effusion in dogs. Journal of the American Veterinary Medical Association, 242(4), 493‑498. https://doi.org/10.2460/javma.242.4.493
5. Chen, C. Y., Fransson, B. A., & Nylund, A. M. (2017). Intrapericardial cystic hematoma in a dog treated by thoracoscopic subtotal pericardectomy. Journal of the American Veterinary Medical Association, 250(8), 894‑899. https://doi.org/10.2460/javma.250.8.894
6. de Ridder, M., Kitshoff, A., Devriendt, N., Or, M., Rubio - Guzman, A., & de Rooster, H. (2017). Transdiaphragmatic pericardiectomy in dogs. Veterinary Record, 180(4), 95. https://doi.org/10.1136/vr.103962
7. Guglielmini, C., Diana, A., Santarelli, G., Torbidone, A., di Tommaso, M., Baron Toaldo, M., & Cipone, M. (2012). Accuracy of radiographic vertebral heart score and sphericity index in the detection of pericardial effusion in dogs. Journal of the American Veterinary Medical Association, 241(8), 1048‑1055. https://doi.org/10.2460/javma.241.8.1048
8. Hennink, I., Düver, P., Rytz, U., Meneses, F., Moioli, M., Adamik, K. N., & Kovačević, A. (2021). Case Report : Unusual Peritoneopericardial Diaphragmatic Hernia in an 8-Month-Old German Shepherd Dog, Associated With a Pericardial Pseudocyst and Coexisting Severe Pericardial Effusion Resulting in Right-Sided Heart Failure. Frontiers in Veterinary Science, 8. https://doi.org/10.3389/fvets.2021.673543
9. Krentz, T. A., Schutrumpf, R. J., & Zitz, J. C. (2017). Focal intramural pericardial effusion and cardiac tamponade associated with necrotic adipose tissue in a dog. Journal of the American Veterinary Medical Association, 251(2), 201‑205. https://doi.org/10.2460/javma.251.2.201
10. Scollan, K., Bottorff, B., Stieger-Vanegas, S., Nemanic, S., & Sisson, D. (2014). Use of Multidetector Computed Tomography in the Assessment of Dogs with Pericardial Effusion. Journal of Veterinary Internal Medicine, 29(1), 79‑87. https://doi.org/10.1111/jvim.12479
11. Yoon, H. Y., Lee, S., & Jeong, S. W. (2015). Intercostal thoracotomy in 20 dogs : muscle-sparing versus traditional techniques. Journal of Veterinary Science, 16(1), 93. https://doi.org/10.4142/jvs.2015.16.1.93