Par Marine HEBERT, Assistante de Médecine Interne
Si vous avez coché "L’évaluation de l’infiltration des nœuds lymphatiques sentinelles est préférable à celle des nœuds lymphatiques régionaux", c'est la bonne réponse 😁
Explications :
Les mastocytomes font partie des phénomènes néoplasiques les plus courants chez nos carnivores domestiques. En particulier, les mastocytomes cutanés sont, respectivement chez le chien et le chat, les 3e et 2e type de tumeur cutané les plus fréquents. Ils représentent environ 20% des tumeurs cutanés chez ces mêmes espèces (Blackwood et al., 2012). Le pronostic et la démarche thérapeutique dependent du grade (selon Patnaik et Kiupel), de la présence de marqueurs moléculaires de prolifération (AgNOR, Ki67, c-KiT) mais aussi du stade (Sledge et al., 2016). Selon les données de la littérature, la médiane de survie diminuerait de 6,2 à 0,8 ans en cas de signes de métastases nodales (Krick et al., 2009), sachant qu’environ 50% des nœuds lymphatiques régionaux présenteraient des signes d’infiltration à l’analyse histologique (Ferrari et al., 2018). Or, il semblerait que l’exérèse chirurgicale des nœuds lymphatiques régionaux serait associée à un meilleur taux de survie chez les patients de stade 2 (tumeur solitaire confinée au derme avec infiltration des nœuds lymphatiques régionaux) avec un temps médian de survie accru de 1 à 6 ans tout grade compris (Marconato et al., 2018) et de 0,7 à 1 an pour les hauts grades selon Kiupel (Chalfon et al., 2022). Ainsi, l’identification des nœuds lymphatiques métastatiques au moment du diagnostic a une implication pronostique et thérapeutique majeure, justifiant la réalisation d’un bilan d’extension adapté.
1 - Un bilan d’extension n’est pas nécessaire lors de mastocytome de bas grade d’agressivité (bas grade selon Kiupel ou grade I selon Patnaik) :
Faux. Une étude rapporte que 3/52 (5,8%) des chiens avec un grade 1 selon Patnaik, 48/291 (16,5%) des grades 2 selon Patnaik et 44/295 (14,9%) des bas grades selon Kiupel présentaient une infiltration des nœuds lymphatiques régionaux lors du diagnostic (Stefanello et al., 2015). Ainsi, le grade seul ne peut permettre de prédire la présence de métastases. De même, le recours aux marqueurs de prolifération cités précédemment participe, en association avec le grade, à l’identification des patients à hauts risques de métastases, mais ne dispense pas d’un bilan d’extension.
2 - L’évaluation échographique du foie et de la rate peut se suffire à elle-même et ne pas nécessiter de ponctions à l’aiguille fine de ces organes pour analyse cytologique :
Faux. L’utilité des images échographiques pour prédire l’infiltration métastatique de la rate et du foie est controversée. En effet, les études évaluant la sensibilité et la spécificité des images échographiques chez des patients à haut risque de métastases rapporte des résultats largement insuffisants (rate : sensibilité : 43-71%, spécificité : 68% ; foie : sensibilité : 0 – 71%, spécificité : 93%) (Book et al., 2011, Pecceu et al., 2020, Sato et al., 2004). Ainsi, sachant que la présence de métastases à distance impacte le pronostic mais aussi la prise en charge thérapeutique, il semble plus raisonnable de ponctionner systématiquement le foie et la rate pour soumission à l’analyse cytologique en cas de mastocytome (et d’autant plus en cas de critères en faveur d’un haut risque de métastases !). Il est toutefois important de noter, que la présence de quelques mastocytes d’aspect normal peut être physiologique et ne pas témoigner d’une infiltration néoplasique.
3 - L’évaluation échographique du foie et de la rate peut se suffire à elle-même et ne pas nécessiter de ponctions à l’aiguille fine de ces organes pour analyse cytologique :
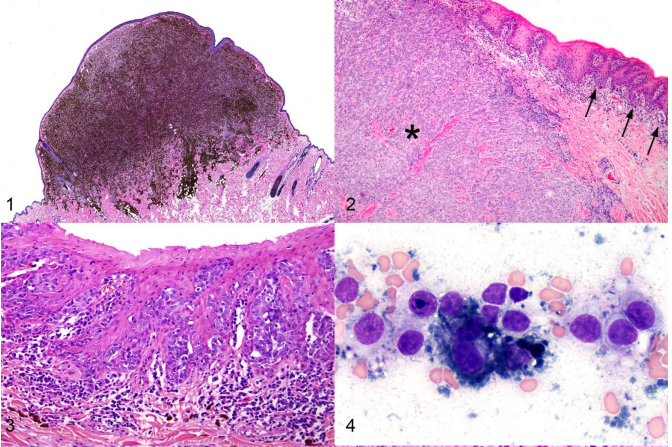
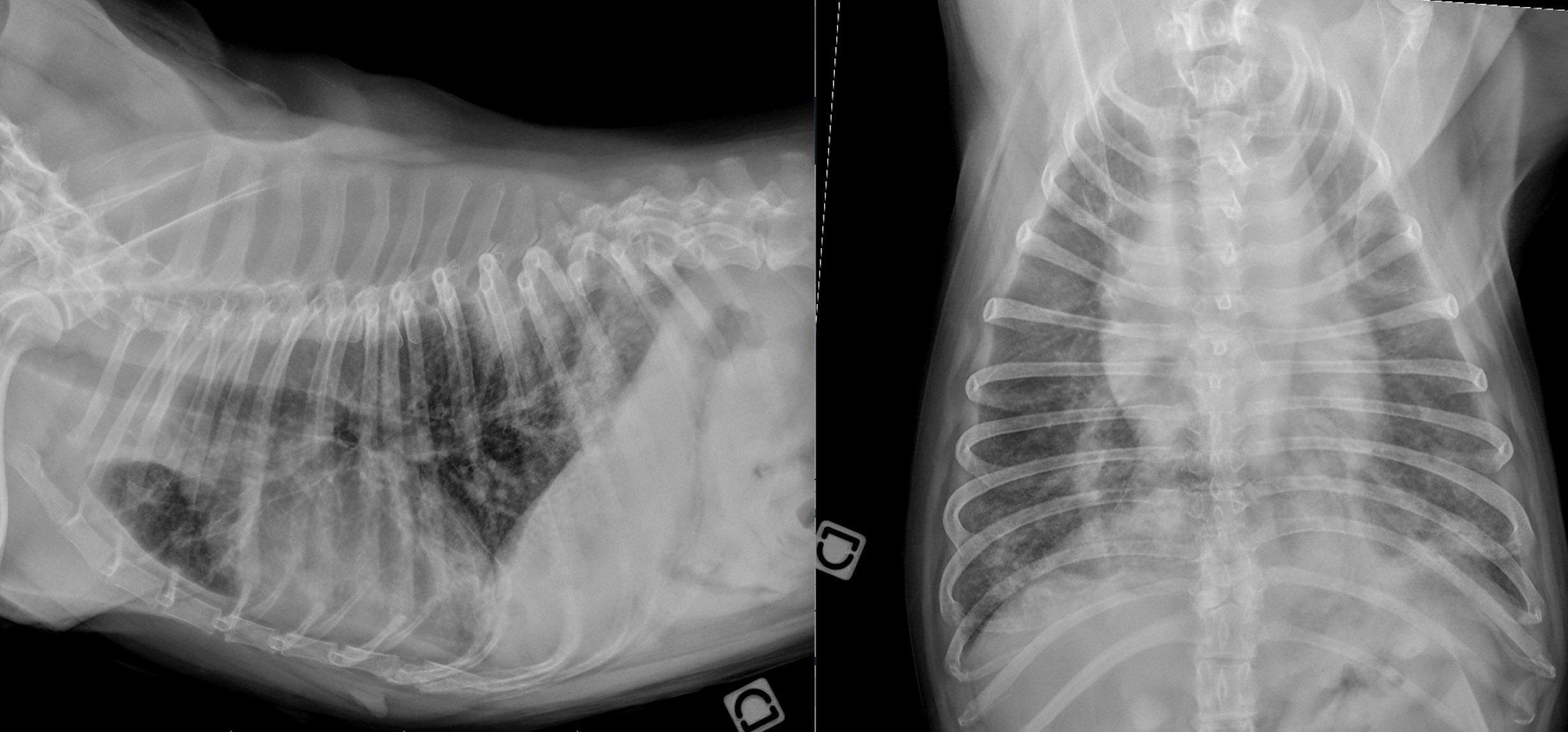
Vrai. La cartographie des nœuds lymphatiques sentinelles permet d’identifier quels nœuds lymphatiques drainent le mastocytome. Or de nombreuses études rapportent un défaut de concordance entre nœuds lymphatiques sentinelles et nœuds lymphatiques régionaux (chez 27 à 63% des patients suivants les études (Ferrari et al., 2018 ; Gianni et al., 2024 ; Laspley et al., 2020 ; Worley et al., 2012)). Ainsi l’identification de métastases suite à l’évaluation des nœuds lymphatiques sentinelles aurait conduit à l’ajout d’un traitement adjuvant chez 8/19 chiens par rapport à l’évaluation des nœuds lymphatiques régionaux dans une étude (Worley et al., 2012). Chez l’homme comme chez les carnivores domestiques, différentes techniques permettent de détecter ces nœuds lymphatiques sentinelles par des méthodes peropératoires (injection de colorant (bleu de méthylène par exemple) (Ferrari et al., 2020 ; Worley et al., 2012)) ou préopératoires (lymphangiographie indirecte par scintigraphie (Ferrari et al., 2020 ; Worley et al., 2012), examen tomodensitométrique (Lapsley et al., 2020), radiographique (De Bonis et al., 2020 ; Annoni et al.,2023) ou par échographie de contraste (Fournier et al., 2020)). En médecine humaine, la lymphoscintigraphie est considérée comme le « gold standard » mais n’est disponible que dans peu de centres vétérinaires. L’utilisation de la lymphangiographie indirecte par examen tomodensitométrique a été largement employée pour la réalisation des bilans d’extension de différents types de tumeurs et semble performante en cas de mastocytome cutané ou sous-cutané; il s’agit de la technique employée à AzurVet comme le montre la figure 1.

Figure 1 : lymphangiographie indirecte par examen tomodensitométrique chez un chien souffrant d’un mastocytome sous cutané de bas grade localisé sur le flanc droit. A. Analyse cytologique du mastocytome avec visualisation de nombreux mastocytes bien différenciés (flèches rouges). B et C. Visualisation du drainage lymphatique du mastocytome sous cutané avec identification du nœud lymphatique axillaire comme nœud lymphatique sentinelle (flèches bleues) – Images : Dr Rannou et Dr Cauvin – AzurVet
Il est toutefois important de noter que l’identification de métastases par analyse cytologique n’est pas parfaite : c’est une méthode faiblement invasive et facilement réalisable mais plusieurs études rapportent un défaut de sensibilité comparée à l’analyse histologique (50-75% seulement (Fournier et al., 2018 ; Ku et al., 2017 ; Lapsley et al., 2020)).
REFERENCES :
ANNONI M., BORGONOVO S., ARALLA M. (2023) Sentinel lymph node mapping in canine mast cell tumours using a preoperative radiographic indirect lymphography: Technique description and results in 138 cases. Veterinary and Comparative Oncology 21(3), 469‑481
BLACKWOOD L., MURPHY S., BURACCO P., et al. (2012) European consensus document on mast cell tumours in dogs and cats. Vet Comparative Oncology 10(3)
BOOK A.P., FIDEL J., WILLS T., et al. (2011) Correlation of ultrasound findings, liver and spleen
cytology, and prognosis in the clinical staging of high metastatic risk canine mast cell tumors. Vet Radiol Ultrasound 52(5), 548‑554
CHALFON C., SABATTINI S., FINOTELLO R., et al. (2022) Lymphadenectomy improves outcome in dogs with resected Kiupel high-grade cutaneous mast cell tumours and overtly metastatic regional lymph nodes. J Small Anim Pract 63(9), 661‑669
DE BONIS A., COLLIVIGNARELLI F., PAOLINI A., et al. (2022) Sentinel Lymph Node Mapping with Indirect Lymphangiography for Canine Mast Cell Tumour. Veterinary Sciences 9(9), 484
FERRARI R., MARCONATO L., BURACCO P., et al. (2018) The impact of extirpation of non-
palpable/normal-sized regional lymph nodes on staging of canine cutaneous mast cell tumours: A
multicentric retrospective study. Vet Comp Oncol 16(4), 505‑510
FOURNIER Q., CAZZINI P., BAVCAR S., et al. (2018) Investigation of the utility of lymph node fine‐needle aspiration cytology for the staging of malignant solid tumors in dogs. Veterinary Clinical Pathol 47(3), 489‑500
FOURNIER Q., THIERRY F., LONGO M., et al. (2021) Contrast-enhanced ultrasound for sentinel lymph node mapping in the routine staging of canine mast cell tumours: A feasibility study. Veterinary and Comparative Oncology 19(3), 451‑462
GIANNI B., FRANCHI R., MATTOLINI M., et al. (s. d.) CT features of cutaneous and
subcutaneous canine mast cell tumors and utility of conventional and indirect lymphography to detect clinically unknown mast cell tumors and to map the sentinel lymph nodes. Veterinary Radiology & Ultrasound
KRICK E.L., BILLINGS A.P., SHOFER F.S., WATANABE S., SORENMO K.U. (2009) Cytological
lymph node evaluation in dogs with mast cell tumours: association with grade and survival. Vet Comp
Oncol 7(2), 130‑138
KU C.-K., KASS P.H., CHRISTOPHER M.M. (2017) Cytologic-histologic concordance in the diagnosis of neoplasia in canine and feline lymph nodes: a retrospective study of 367 cases. Vet Comp Oncol 15(4), 1206‑1217
LAPSLEY J., HAYES G.M., JANVIER V., et al. (2021) Influence of locoregional lymph node aspiration cytology vs sentinel lymph node mapping and biopsy on disease stage assignment in dogs with integumentary mast cell tumors. Veterinary Surgery 50(1), 133‑141
MARCONATO L., POLTON G., STEFANELLO D., et al. (2018) Therapeutic impact of regional lymphadenectomy in canine stage II cutaneous mast cell tumours. Vet Comparative Oncology 16(4),
580‑589
PECCEU E., SERRA VARELA J.C., HANDEL I., et al. (2020) Ultrasound is a poor predictor of early or overt liver or spleen metastasis in dogs with high-risk mast cell tumours. Vet Comp Oncol 18(3), 389‑401
SATO A.F., SOLANO M. (2004) Ultrasonographic findings in abdominal mast cell disease: a retrospective study of 19 patients. Veterinary Radiology & Ultrasound 45(1), 51‑57
SLEDGE D.G., WEBSTER J., KIUPEL M. (2016) Canine cutaneous mast cell tumors: A combined clinical and pathologic approach to diagnosis, prognosis, and treatment selection. The Veterinary Journal, Special Issue: Recent Developments in Veterinary Diagnostics 215, 43‑54
STEFANELLO D., BURACCO P., SABATTINI S., et al. (2015) Comparison of 2- and 3-category
histologic grading systems for predicting the presence of metastasis at the time of initial evaluation in dogs with cutaneous mast cell tumors: 386 cases (2009-2014). J Am Vet Med Assoc 246(7), 765‑769
THAMM D., VAIL D. (2001) Mast cell tumours. In Small Animal Clinical Oncology, Eds WITHROW S., MCEWEN E.G., WB Saunders Co. ed. Philadelphia, pp 261‑282
WORLEY D.R. (2014) Incorporation of sentinel lymph node mapping in dogs with mast cell tumours: 20 consecutive procedures. Vet Comparative Oncology 12(3), 215‑226